Donanemab: Alzheimer'a yönelik yeni ilacı onaylayan FDA da yolsuzluk!
BMJ 2024;386:q2010
Alzheimer hastalığı için yeni bir ilaç, aşırı ölümlere, eksik güvenlik verilerine, şüpheli etkinliğe ve onayı öneren "bağımsız" danışma panelistleri arasındaki mali çıkar çatışmalarına rağmen onay alabiliyor.
Donanemab Eli Lilly tarafından geliştirilmiş ve 2 Temmuz'da ABD Gıda ve İlaç Dairesi (FDA) tarafından onaylanmıştır. Alzheimer hastalığı için yeni bir tedavi sınıfının sonuncusudur ve medyada "çığır açan ilaçlar" ve durum için ilk "hastalığı değiştiren tedaviler" olarak çokça övülmüştür. Ancak bunların etkinliği sorgulanmaktadır. Donanemab, daha önce onaylanan iki Alzheimer ilacı gibi, yalnızca etkinliği ve ilacı kullanan hastalar arasındaki ölüm sayısıyla ilgili değil, aynı zamanda FDA danışma komitesi üyeleri arasında ilaç üreticileriyle olan mali bağlarla ilgili sorularla da karşı karşıyadır. BMJ, donanemab'ın onaylanmasını öneren üç danışmanın, üreticisi Lilly'den doğrudan ödeme veya araştırma fonu aldığını gösterdi.
Ölümler ve olumsuz olaylar
Ocak 2023'te FDA, Lilly'ye donanemab'ın onayını reddeden bir mektup gönderdi. Ajans, bir brifing belgesinde "yüksek oranda" eksik veri olduğunu belirtti ve "güvenlik veritabanının ilacın uzun vadeli güvenliğini yeterince karakterize etmek için yetersiz" olduğu sonucuna vardı. FDA, Lilly'nin 3. faz denemesinde donanemab alan hastalarda yan etkiler nedeniyle tedavinin kesilmesinin plasebo grubundakinden daha yaygın olduğunu belirtti. Tedaviyi kesen hastalar genellikle araştırmacılar tarafından çalışmadan çekildi ve nihai analizden çıkarıldı. FDA, bunun "eksik hayati durum bilgisine" yol açtığını, yani Lilly deneme araştırmacılarının önemli sayıda test katılımcısının ölü mü yoksa diri mi olduğunu bilmediğini söyledi. Beyin kanaması ve şişmesi, toplu olarak amiloid ilişkili görüntüleme anormallikleri (ARIA) olarak adlandırılır ve donanemab alan hastaların %36,8'inde ve plasebo hastalarının %14,9'unda meydana gelmiştir. İnfüzyon reaksiyonlarıyla birlikte, ARIA tedavinin kesilmesine yol açan en sık görülen yan etkiydi. Lilly, araştırmacıların ilaca bağladığı ARIA nedeniyle donanemab alan hastalarda üç ölüm olduğunu kabul etti.
Güvenlik endişeleri nedeniyle FDA, Lilly'nin ölümler, beyin kanaması ve ödem gibi olayları izlemek için pazar sonrası "kayıt tabanlı, prospektif, gözlemsel bir çalışma" yürütmesini zorunlu kılıyor. Şirkete nihai güvenlik raporunu yayınlaması için 13 yıl (Şubat 2037'ye kadar) veriyor. Lilly, FDA'ya iki yılda bir rapor sunmak zorunda.
Washington, DC'deki Ulusal Sağlık Araştırmaları Merkezi başkanı Diana Zuckerman, sadece kayıt verilerine güvenmek ve Lilly'ye 2037'ye kadar süre vermek kabul edilemez. Bu, sadece birkaç yıl sonra ortaya çıkacak telafisi mümkün olmayan zarar ve ölümlerdeki potansiyel artışa ilişkin açık endişelere rağmen hastaların ve ailelerinin ihtiyaçlarına karşı kayıtsızlığı gösteriyor diyerek endişelerini belirtti.
ARIA ve denemelerdeki ölümlerle ilgili endişelerin yanı sıra uzmanlar, donanemab gibi ilaçların nörodejenerasyonu kötüleştirebileceğini söylüyor.
Çıkar çatışmaları
FDA'nın donanemab'ı onaylaması, ajansın danışma komitesinin (bir çekimserle) oybirliğiyle aleyhte oy kullanmasına rağmen, aducanumab'ı (Biogen ve Eisai'nin Aduhelm'i) tartışmalı bir şekilde onaylamasının ardından geldi . Birçoğu bağımsız akademisyen olan danışmanlar, ajansın şirketin klinik son nokta yerine bir tali sonuçla (azaltılmış amiloid) ile değiştirmesine izin verme kararına itiraz ettiler. Klinik olarakprimer end-point çalışmalarında net bir fayda gösterilememişti. Üç danışman protesto amacıyla istifa etti ve basında bir fırtına koptu. FDA'nın onay sürecinin "düzensizliklerle dolu" olduğunu tespit eden bir Kongre soruşturması izledi.
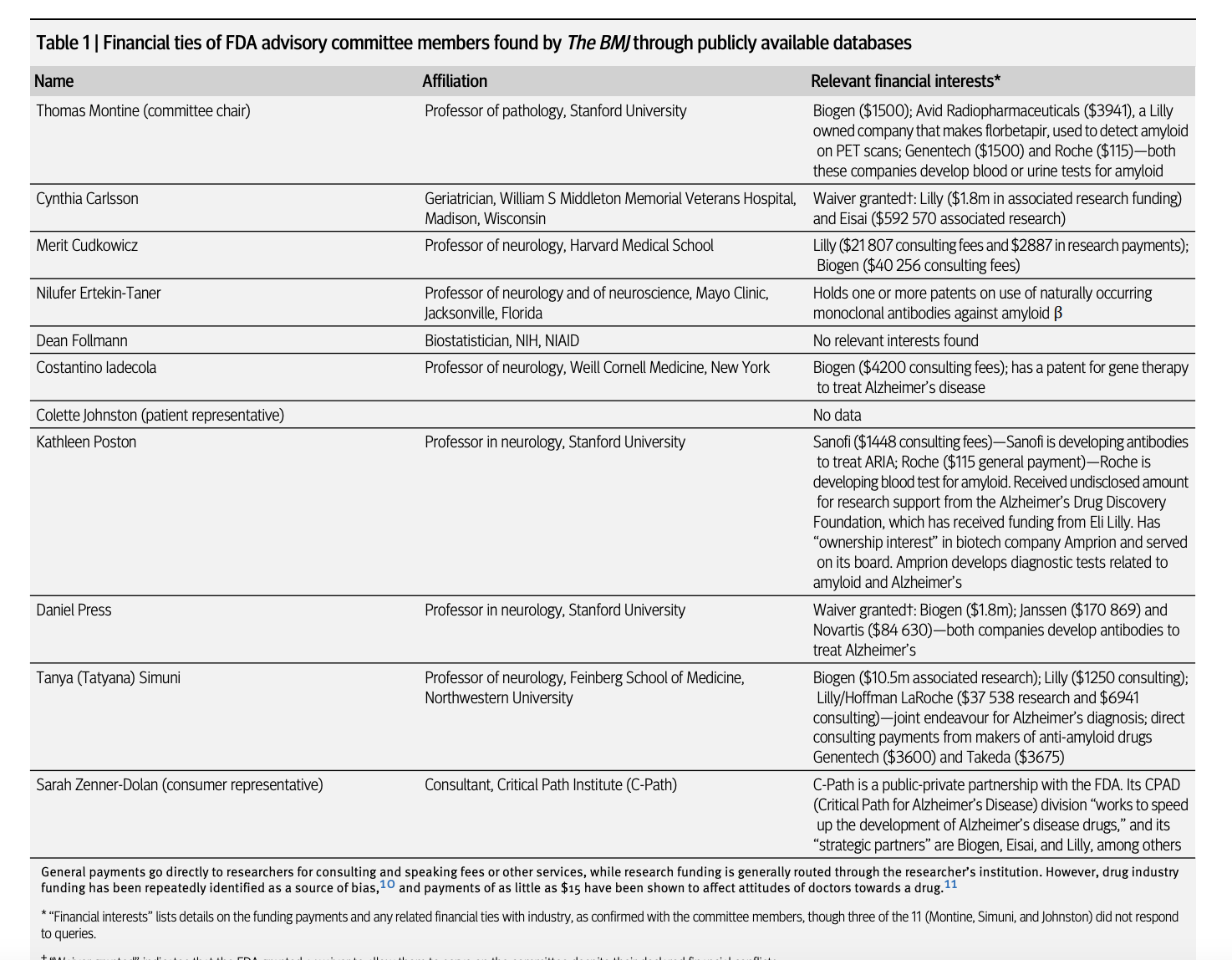
Bu gruptan ikinci ilaç olan lecanemab (Eisai ve Biogen'in Leqembi'si), 2023'te incelemeye alındı. O zamana kadar FDA, aducanumab'ı eleştiren danışma komitesinin 11 üyesinin hepsini değiştirmişti. Ajans, lecanemab'ı incelemek üzere komiteye dört yeni doktor atadı; bunların hepsi veya işverenleri, 2017'den 2023 sonuna kadar lecanemab üreticileriyle finansal bağlara sahipti. İki ek danışman, bir biyoistatistikçi ve bir hasta temsilcisi için finansal bağlara ilişkin kamuya açık veri mevcut değildi. Yeni ve çok daha küçük altı üyeli komite, lekanemabı oy birliğiyle onayladı ve FDA, Temmuz 2023'te ilaca onay Verdi.Donanemab bu yılın başlarında incelemeye alındığında, FDA danışma komitesini sekiz hekim de dahil olmak üzere 11 üyeye genişletti. Kamuya açık veritabanı OpenPayments, üyelerin özgeçmişleri, yayınlanmış makalelerdeki açıklamalar ve diğer bilgileri incelediğinde, bireysel danışmanların 2017'den 2023 sonuna kadar danışmanlık ve konuşma ücretleri için 62.000 dolara kadar ücret ve araştırma fonu olarak 10,5 milyon dolar aldığını buldu.
Lilly ile finansal bağları olan üç hekim danışmanın ikisinin Alzheimer hastalığı için yeni bir kan testi oluşturmada Lilly'nin geliştirme ortağı olan Roche ile bağlantıları vardı. Diğer iki doktorun amiloid antikorları üzerinde patentleri vardı ve sekizinci doktor başka bir Alzheimer ilacı için Janssen'den araştırma fonu almıştı. Bu tür finansal çatışmalar önemlidir çünkü bir sınıftaki bir ilacın ortak etki mekanizmasından kaynaklanan başarısızlığı, sınıftaki tüm ilaçları ve testleri düzenleyiciler tarafından reddedilme riskiyle karşı karşıya bırakabilir.
Çıkar çatışmalarına ilişkin federal yasa, danışman üyelerin “[danışmanın] veya işverenin mali çıkarları üzerinde doğrudan ve öngörülebilir bir etkiye sahip” şirketlerle bağ kurmasını yasaklamaktadır.
Söz konusu etkinlik
Donanemab çalışmalarının birincil son noktası, günlük yaşam aktiviteleri ve bilişin 144 puanlık bileşik ölçeği olan entegre Alzheimer hastalığı derecelendirme ölçeğindeki (iADRS) puanlardı. Test, 2015 yılında Lilly tarafından oluşturuldu. FDA, Lilly'nin kendi testini kullanmasına itiraz etti ve şirketin daha yaygın olarak kabul gören "klinik bunama derecelendirme ölçeği" (CDR-SB) testini kullanmasını istedi. Kurum, şirketin "çalışmanın yürütülmesi sırasında birincil son noktayı [CDR-SB'den] iADRS'ye değiştirdiğini" ve "kurumun bu değişikliğe katılmadığını" söyledi. 2021'de Lilly, 2. faz denemesinin, FDA'nın Lilly'nin birincil sonuç olarak kullanmasını istediği CDR-SB puanı açısından ilacı ve plaseboyu alan hastalar arasında "önemli bir fark göstermede başarısız olduğunu" bildirdi. Lilly, bunun yerine birincil sonuç olarak iADRS puanında 3,2 puanlık bir fark bildirdi. 3,2 puanlık fark, Lilly'nin iADRS kriterlerine göre en az 5 puanlık bir fark gerektirecek olan klinik olarak anlamlı fark seviyesinin çok altında kaldı. Sonraki faz 3 denemesi daha da küçük bir etki buldu: iADRS'de 2,92'lik bir fark. Bu sefer ikincil son nokta olan CDR-SB, istatistiksel olarak anlamlı 0,7'lik bir farka ulaştı. Ancak bu sonuç, Lilly'nin 2019'da 35.000 hasta üzerinde yaptığı çalışmalardan belirlediği klinik olarak anlamlı etki için en düşük eşik olan 1 ila 1,6 puana ulaşmayı da başaramadı.







